HPV相关恶性肿瘤
人乳头瘤病毒是世界上最常见的性传播感染。大多数 HPV 感染在感染后 2 年内会自行清除;然而,持续感染可导致多种疾病,甚至可以引起肿瘤。大多数宫颈癌、肛门癌和口咽癌均由 HPV 感染引起,而宫颈癌是全球女性癌症死亡的主要原因之一。HPV 感染对 HIV 感染者的影响尤为严重,导致病毒清除率下降、癌症发病率上升和死亡率上升。已证明 HPV 疫苗可使 HPV 相关疾病的发病率大幅下降。首次性行为前接种该疫苗可有效预防宫颈癌,其有效性接近 100%。由于缺乏疫苗获取途径以及对 HPV 的了解有限,全球 HPV 疫苗接种率仍然很低。提高对 HPV 的认识并促进疫苗接种,对于降低全球癌症及 HPV 相关疾病的发病率和死亡率至关重要。
HPV 是一种无包膜的双链 DNA 病毒。1949 年,Strauss 等人首次使用电子显微镜发现了此病毒呈二十面体形。1976 年,Harald zur Hausen 假设 HPV 与宫颈癌之间存在联系,并在随后的十年内,他的团队成功从宫颈癌活检样本中分离出两种新型毒株,HPV 16 和 18,这项实验后来为他赢得了诺贝尔医学奖。如今已经确认了 170 多种 HPV 基因型,可分为低危和高危基因型。其中,至少有 12 种高危菌株,如 HPV 16、18、31 和 45 是导致 HPV 的大多数癌症的病因。低风险菌株,如 HPV 6 和 11,很少导致癌症,但可导致生殖器、肛门、口腔和喉咙的病毒疣。
HPV 感染机制尚不完全清楚。最普遍接受的机制是 HPV 通过内吞作用穿过上皮基底膜的微病变进入细胞,然后转位到细胞核进行基因组复制和转录。HPV 基因组有八个开放阅读框:E1、E2、E4、E5、E6 和 E7;以及两个晚期区域:L1 和 L2。这些阅读框促进复制和转录,而这些过程由宿主蛋白完成。研究主要集中在 E6 和 E7 框上,因为它们在破坏细胞生长和分化方面发挥作用。晚期区域 L1 和 L2 的作用是将扩增的基因组包装成病毒体,形成二十面体衣壳。最终,病毒通过自然脱落离开细胞,通常感染上皮细胞。
HPV 通过性接触传播,通常通过皮肤-皮肤或皮肤-粘膜接触。80% 以上的性活跃成年人在其一生中会接触 HPV。极少数情况下,HPV 可以在围产期垂直传播。有罕见的报道称,从未有过性接触的个体也会发生自身接种或间接感染。
疾病患病率
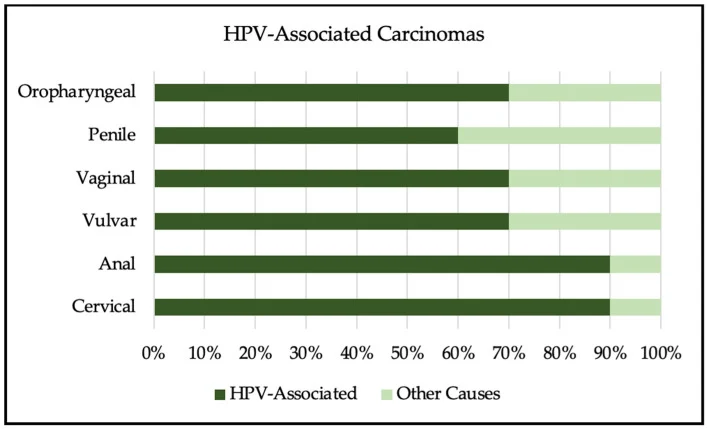
HPV 感染通常无症状。低危 HPV 病毒株可导致跖疣、寻常疣或生殖器疣,以及局灶性呼吸道乳头状瘤病;高危 HPV 病毒株则与宫颈上皮内瘤变 (CIN) 以及宫颈癌、阴道癌、外阴癌、肛门癌、阴茎癌和口咽癌有关。据估计,90% 的宫颈癌和肛门癌、70% 的外阴癌和阴道癌、60% 的阴茎癌以及 70% 的口咽癌均由持续性高危 HPV 感染引起,如图 1 所述。
图1. HPV相关肿瘤(看不到图片点这里)
HPV 感染导致癌症,这是因为 HPV 基因组中 E6 和 E7 阅读框上调,从而分别抑制宿主细胞中的 p53 和 Rb。E6 和 E7 的上调可导致顿挫性感染,即病毒基因组失调,从而阻止传染性病毒的产生。HPV 还可导致增殖性感染,从而使病毒的生命周期正常运作。HPV 感染后致癌的具体机制因感染部位而异。宫颈癌通常发生在宫颈从复层鳞状上皮过渡到柱状上皮(称为移行区)的地方。据推测,该区域由充当干细胞的储备细胞组成。一旦感染 HPV,病毒基因表达将无法调节,导致化生并最终导致癌症。储备细胞中病毒生命周期的失调是由于顿挫性感染增加,而不是增殖性感染增加。 HPV 感染导致的肛门癌与宫颈癌的发病模式相似,因为 HPV 通常会感染肛门移行区导致癌症。HPV 相关的口咽癌的发病机制可能与宫颈癌和肛门癌的 HPV 致癌机制不同。口咽部由扁桃体隐窝上皮构成,更容易感染 HPV,因此更容易发生顿挫性感染而非增殖性感染。这增加了病毒基因表达失调的风险,从而导致癌症。
根据世界卫生组织 (WHO) 2022 年全球癌症观察站的数据,宫颈癌是第八大常见癌症,也是第九大癌症死亡原因。宫颈癌是非洲和东南亚女性中第二大常见癌症,乳腺癌是最常见的癌症。口咽癌是全球第 24 大常见癌症,每年新发 106,400 例。其中,估计 70% 是由高危 HPV 感染引起的。
HPV 筛查通常仅针对女性进行,但并非普遍进行。因此,难以获得真实的患病率。中低收入国家 (LMIC),宫颈癌筛查率估计为 44%。美国筛查率估计为 72.4%。2019 年对乌干达西部 1892 名患者的研究发现,从自我采集的样本中,25 至 49 岁女性中高危 HPV 的患病率为 21%。中国,2021 年对 427,401 名 20 岁或以上女性进行的一项研究显示,宫颈 HPV 的患病率为 15.0%,高危 HPV 的患病率为 12.1%。美国,15 至 59 岁男性和女性的 HPV 总体患病率为 40.0%,其中男性高危患病率分别为 24.2% 和 19.9%。男性通常不会接受 HPV 筛查。然而,最近的一项荟萃分析估计,15 岁以上男性中,三分之一男性曾经感染过 HPV,21% 的人感染了高危 HPV。
诊断和预后
美国和许多其他资源丰富的地区,筛查最常用的是宫颈巴氏涂片 (Pap) 。根据美国预防服务工作组 (USPSTF) 和美国阴道镜和宫颈病理学会的建议,建议 21 岁起的女性每三年进行一次巴氏涂片检查。30 岁以上的女性,每五年进行一次 HPV 联合检测和宫颈巴氏涂片检查、每五年单独进行一次 HPV 检测或每三年进行一次巴氏涂片检查,如果之前的检测结果为阴性,则所有检测截止到 65。美国疾病控制与预防中心建议 HIV 感染女性从 21 岁开始每年筛查一次,连续三年,然后每三年终生进行一次巴氏涂片检查或巴氏涂片检查和 HPV 联合检测。如果宫颈巴氏涂片检查和 HPV 检测均为阴性,则五年内患 CIN III 或更高级别病变的发病率为 0.7%。自 2021 年起,世界卫生组织建议所有女性从 30 岁起仅进行 HPV DNA 检测筛查,而不是巴氏涂片细胞学检查或醋酸白检测,每 5 至 10 年间隔一次,并在两次筛查检测阴性后结束。HIV 感染女性,此建议有所改变。HPV DNA 检测的初次筛查从 25 岁开始,间隔 3 至 5 年。指南的比较显示在表 1 中。
荷兰一项纳入 12,113 名女性的研究发现,仅使用 HPV DNA 检测进行筛查时,高危 HPV 的患病率为 8%。2453 名伊朗女性的 HPV DNA 筛查显示,10.3% 患有高危 HPV。 世界卫生组织指出,HPV DNA 筛查可自我采样,可提高筛查率,因为有些女性感觉自我采样比传统的医疗采样更舒适。
|
表1. HPV筛查指南 |
||
|
年龄 |
USPSTF 和 CDC |
WHO |
|
21岁以下 |
不推荐 |
不推荐 |
|
21-30 |
每3年一次巴氏涂片 |
不推荐 |
|
30-65 |
每5年一次巴氏涂片+HPV,或每5年一次HPV,每3年一次巴氏涂片 |
每5-10年一次HPV检测,如果两次阴性则结束 |
|
合并HIV感染 |
21岁始,每年一次巴氏涂片检查,如果连续3年阴性,则每年一次巴氏涂片检查或巴氏联合HPV检查,并持续终生 |
25岁起,每3-5年进行一次HPV检测 |
|
注:USPSTF,United States Preventative Services Task Force,美国预防服务工作组 |
||
有许多方法可以检测 HPV 感染。美国通常 HPV 检测联合宫颈细胞学涂片检测,一般诸如 Digene® HPV 检测或 Cervista® HPV 高危检测试剂盒。聚合酶链反应 (PCR) 检测和病毒载量定量也可用于检测 HPV。美国疾病控制和预防中心 (CDC) 目前不建议对男性进行 HPV 感染筛查,因为目前没有有效的测试;但是有肛交史或感染 HIV 男性可以使用肛门巴氏试验检测。
由于巴氏涂片需要专业的病理设备和专业人员,因此许条件无法满足时可使用醋酸白试验 (VIA)。一般使用 3-5% 醋酸,将其涂于子宫颈 1 至 2 分钟。如果宫颈变白则表明可能存在潜在感染。2015 年一项针对 39,740 名女性的研究分析了醋酸白试验的诊断准确性,结果显示,7.1% 的筛查女性醋酸白试验呈阳性,其中 92.8% 的宫颈正常或 CIN I 病变,表明醋酸白试验筛查的阳性预测值较低。
HPV 筛查主要集中高危患者。这意味着筛查通常是针对宫颈癌和肛门癌的,而 HPV 相关口咽癌的筛查有限。有人使用 ctHPVDNA 的血浆循环标志物筛查 HPV。一项纳入 97 例局部局限型 HPV 相关口咽鳞状细胞癌患者的研究发现,90 例患者中检测到 HPV16 ctDNA,在 3 例患者中检测到 HPV33 ctDNA。这表明 ctHPVDNA 测试的敏感性为 95.6%。所有对照均呈阴性,因此特异性100% 。虽然该检测主要用于研究,但其高灵敏度和特异性有望用作筛查检测,特别是筛查与 HPV 相关的口咽癌。
总体而言,HPV 感染本身的预后仍然良好。在 12-24 个月内,90% 的感染无法检测到,表明病毒自发清除 [ 30 ]。未清除的感染可引起临床疾病。HPV 导致的死亡最常见的原因是宫颈癌。在对 2013 年至 2019 年美国所有阶段宫颈癌的分析中,所有个体的 5 年生存率为 67.2% [ 31 ]。如果癌症已经转移,5 年生存率下降到 19% [ 31 ]。2022 年一项分析 ICD-10 代码的研究显示,患有 HPV 相关口咽癌的个体的总生存率在男性中为 81.5%,在女性中为 80.6% [ 32 ]。
治疗
目前针对 HPV 感染的治疗未有充分的研究,现有的治疗方法主要是针对 HPV 感染引起的症状和疾病,例如疣或癌症。
尖锐湿疣的治疗方法有局部治疗和物理切除或破坏。局部疗法有咪喹莫特、鬼臼毒素、赛儿茶素和异维 A 酸,最常用的选择是咪喹莫特和鬼臼毒素。物理切除和破坏治疗包括简单的手术切除、液氮消融、电灼和光动力疗法。
CIN II 或 III 的治疗选择有锥切术、冷冻疗法和环形电外科切除术 (LEEP)。对于宫颈癌,分期对于确定治疗方法很重要。由于中低收入国家宫颈癌的负担明显较高,因此历史上宫颈癌的分期系统基于临床。该系统能够根据现有资源更好地诊断和分期宫颈癌。2018 年,国际妇产科联合会 (FIGO) 将横断面成像和病理学纳入分期系统。早期阶段可以用简单的子宫切除术或锥切术治疗,而晚期可能需要子宫切除术、放疗和/或化疗。化疗历来以顺铂为基础;随着对单药治疗的耐药性增加,现在多以顺铂为基础的化疗与另一种疗法(如拓扑替康、紫杉醇、5-氟尿嘧啶或博来霉素)联合使用时,治疗更有效。对于局部晚期宫颈癌,通常建议放疗与联合化疗方案一起进行。
与宫颈癌一样,肛门癌的治疗也依赖于分期。局部切除可用于不涉及括约肌且通常不需要进一步治疗的小病变。病情更晚期的患者需要在切除前进行治疗,通常是放疗和化疗。最常用的多模式方法是局部切除,然后进行丝裂霉素、5-氟尿嘧啶和放疗。如果癌症是转移性的,则需要加用基于顺铂的治疗。
HPV 相关口咽癌的治疗模式与其他 HPV 相关癌症相似。切除通常是第一种治疗方法,可以通过开放手术或微创的激光和机器人手术选项来完成。切除后的护理标准是放疗联合以顺铂为基础的化疗。
预防
预防 HPV 感染的方法旨在防止接触病毒。性传播是 HPV 最常见的传播方式。HPV 的一级预防可以通过禁欲或在性活动前接种疫苗来实现。研究发现,与终生性伴侣少于 5 人的女性相比,拥有 5 个或更多终生性伴侣的 35-60 岁女性对高危 HPV 的检出率增加了两倍多。荟萃分析发现,安全套有保护作用。研究发现,母亲在怀孕期间 HPV 检测呈阳性的新生儿中有 5.2% 也检测到 HPV。由于垂直传播率低,如果母亲感染了 HPV,不建议进行剖宫产。2016 年的一项研究发现,剖宫产后病毒的围产期传播减少了 46%;然而,15% 的剖宫产患者发生了 HPV 感染。防止母婴垂直传播的最佳方法是保护母亲免受 HPV 感染。为了防止自体接种和间接接触,良好的手部卫生仍然很重要。
HPV 疫苗和功效
2006 年美国首次获批使用HPV 疫苗。目前有三种主要类型的疫苗可用:二价、四价和九价。二价疫苗针对 HPV 16 和 18,四价疫苗针对 HPV 6、11、16 和 18,最新的疫苗是默克公司品牌 Gardasil® 下的九价疫苗,针对 HPV 6、11、16、18、31、33、45、52 和 58。
HPV 疫苗是一种非感染性重组疫苗,由 L1 蛋白的病毒样颗粒制成,该颗粒从每种相关的 HPV 类型中纯化。预计超过 98% 的人在完成疫苗系列接种后一个月会出现抗体反应。尚未确定最低保护性抗体滴度水平。该疫苗还通过改变循环中的抗体类型来提高 B 细胞免疫力。为了响应自然的 HPV 感染,会形成非中和抗体。如果在感染 HPV 16 后接种一剂疫苗,则会形成中和抗体。CDC 指出,HPV 疫苗可提供持久的感染保护,免疫力至少 12 年不会减弱。
HPV 疫苗的功效可以通过其预防低风险和高危 HPV 感染和疾病的能力。预防尖锐湿疣方面,四价疫苗显示尖锐湿疣的风险显著降低 (OR = 0.03, 95% CI 0.01-0.09) 和尖锐湿疣数量显著减少 (OR = 0.36, 95% CI 0.26-0.51)。预防宫颈癌方面,Palmer 等人在苏格兰进行的一项研究分析了 1988-1996 年出生的女性的癌症登记和疫苗记录,以评估 HPV 疫苗与宫颈癌之间的联系。项研究表明,12-13 岁时接种二价 HPV 疫苗的女性没有浸润性宫颈癌病例,表明疫苗的有效性为 100%。接种三剂疫苗的 14-22 岁女性中,每 100,000 人中有 3.2 人患有宫颈癌,而未接种疫苗的女性每 100,000 人中有 8.4 人患有宫颈癌 。研究表明,早期接种人瘤病毒疫苗可有效预防宫颈癌,并且对 13 岁或以下的女孩最有效。
这些疫苗还被证明可以减少口咽和肛门感染,从而预防后续癌症。2021 年的一项系统评价发现,接种疫苗的人口腔和口咽 HPV 感染的相对降低百分比为 82.7%。对于肛门 HPV 感染,荟萃分析发现,与对照组相比,接种 HPV 疫苗后肛门癌的发病率显著降低(RR = 0.42,95% CI 0.31-0.57;p = 0.02)。
疫苗接种建议
CDC 建议 11 岁和 12 岁的儿童(包括女孩和男孩)接种两剂 HPV 疫苗,每剂间隔 6 到 12 个月。15-26 岁且以前未接种过疫苗的个体应接种三剂 HPV 疫苗。然而,根据早期性行为首次亮相或免疫功能低下状态等因素,CDC 建议最早在 9 岁时接种疫苗,补种疫苗接种长达 45 岁。
WHO 建议 9-14 岁的女孩和 15-20 岁的女性接种一剂或两剂,21 岁以上的女性接种两剂,间隔 6 个月。如果一个人免疫功能低下或感染 HIV,WHO 建议至少接种两剂,如果可行,应接种三剂。HPV 疫苗接种的年龄范围为临床实践提供了灵活性。然而,如果在首次性行为之前接种疫苗,则疫苗最有效。因此,应对所有患者进行风险评估和共同决策,以确定完成疫苗接种系列的最佳年龄。
该疫苗并非在世界上每个国家都有。截至 2020 年 6 月,194 个 WHO 会员国中有 107 个已经引入了至少一种类型的 HPV 疫苗。美洲、欧洲、大洋洲、亚洲和非洲提供 HPV 疫苗接种的国家百分比分别为 85%、77%、56%、40% 和 31%,如图 2 所示。
图 2: WHO 提供的各大洲 HPV 疫苗接种率 (看不到图片点这里)
由于疫苗供应不足,很难确定疫苗的全球接种率,非洲和大洋洲国家尤其低。全球估计表明,疫苗系列的完成率为 15%。乌干达北部 9-14 岁女孩的疫苗接种率为 19.6%,中国的总体接种率为 24.4%,美国 13-15 岁女孩的疫苗接种率为 58.5%。这些数据表明,国家的经济状况可能会影响疫苗接种率。
2017 年 CDC 的一项调查 HPV 疫苗接种相关的因素。与高收入家庭相比,来自低收入家庭的青少年更有可能接种疫苗 (OR = 1.21; 95% CI 1.04–1.43)。这项研究还发现,男性 (OR = 0.74; 95% CI 0.66-0.83) 和家庭医生不建议接种疫苗的青少年 (OR = 0.57; 95% CI 0.49-0.05) 接种疫苗的可能性较小,对疫苗没有安全担忧的青少年更有可能接种疫苗 (OR = 3.24; 95% CI 2.68-3.93)。并非每个国家都能获得疫苗,学校活动、分享有关疫苗有效性和安全性的信息、倡导更多国家将 HPV 疫苗添加到推荐的疫苗接种计划中,以及改变政策以允许或建议男孩和男性也在全球范围内接种疫苗等措施可能提高接种率。
HPV 和 HIV 的混合感染
人类免疫缺陷病毒 (HIV) 是一种以人类辅助性 T 细胞(称为 CD4 T 细胞)为目标的病毒,随着病毒继续攻击 T 细胞,可导致免疫缺陷。HIV 感染的最后也是最严重的阶段是获得性免疫缺陷综合症 (AIDS)。当患者的 CD4 T 细胞计数低于每毫升血液 200 个细胞或患者发生机会性感染时,就会发生艾滋病。HIV 影响全球 3900 万人,非洲国家更为严重,每 25 名非洲成年人中就有 1 名感染 HIV。众所周知,HIV 会导致感染和癌症的风险增加。HIV 和 HPV 感染之存在联系,浸润性宫颈癌被是艾滋病的相关疾病。与未感染 HIV 的患者相比,HIV 感染者的 HPV 感染率是其两倍,HPV 清除率是其一半。乌干达的一项研究发现,49% 的产后妇女感染了高危 HPV 基因型,感染 HIV 的妇女的 HPV 患病率为 86%,而没有 HIV 的妇女为 59% (p = 0.003)。与未感染 HIV 的人相比,HIV 感染者清除 HPV 感染的可能性降低 (HR = 0.31;95% CI 0.21–0.45)。随着 HPV 清除率降低,尤其是高危 HPV,进展为癌症的风险增加。2018 年全球所有新诊断的宫颈癌中,5.8% 是感染 HIV 的女性。HIV 与宫颈癌之间的联系最大的是非洲。25% 的新诊断宫颈癌非洲妇女也感染了 HIV。 其他地区的关联性明显较低,美洲为 1.7%,欧洲为 1.5%,东南亚为 1.4%。浸润性宫颈癌和 HIV 患者死于癌症的风险增加(HR = 1.95;95% CI 1.20 至 3.17)。由于混合感染的风险增加,WHO 建议 HIV 感染者应完成三个系列的 HPV 疫苗接种 。大多数建议还包括增加 HIV 感染者的 HPV 筛查。
HPV 疫苗的前瞻性治疗应用
治疗策略的进步为治疗 HPV 感染带来了希望,以期预防其相关疾病。实现这一目标的途径之一是开发治疗性疫苗。这些是全新的药物,与目前可用的疫苗相似,只是因为它们是通过注射给药的。Ibrahim Khalil 等人于 2023 年完成的一项系统评价和荟萃分析分析了多种新开发的治疗性 HPV 疫苗治疗宫颈癌的有效性。本研究中使用的治疗性疫苗是基于肽、基于蛋白质、病毒载体、细菌载体、基于 DNA 和基于细胞的疫苗。许多治疗性疫苗的靶点是 E6 和 E7 蛋白,它们是影响感染和致癌作用的主要蛋白。据推测,靶向 E2 蛋白可能是治疗性疫苗的理想靶标,因为 E2 蛋白充当 E6 和 E7 蛋白的阻遏蛋白,因此可以防止 p53 和 Rb 失调 。该分析发现,如果对 CIN II 或 III 患者接种治疗性疫苗,则合并结局是病变恢复到正常或 CIN I 的 54%。相比之下,患有 CIN II 或 III 并接受安慰剂疫苗的患者的回归率为 27%。荟萃分析的一项研究着眼于仅针对 E2 蛋白的治疗性疫苗,结果显示 CIN I、II 或 III 病变个体的病灶完全清除。目前有多种治疗性疫苗正在进行 II 期和 III 期试验,但尚未获得临床使用批准。 然而,这些发现表明,使用治疗性 HPV 疫苗治疗 CIN 可能是可行的,并且可能有助于降低进展为宫颈癌和相关死亡率。
一些研究人员还研究了使用广泛使用的预防性 HPV 疫苗作为 HPV 相关疾病的潜在治疗方法。如上所述,预防性疫苗不同于治疗性疫苗,因为预防性疫苗通常是由病毒样颗粒制成的重组疫苗。Karimi-Zarchi 等人在伊朗进行的一项随机对照试验分析了目前可用的预防性四价 HPV 疫苗作为治疗剂的效果。这项研究表明,在接受两剂或更多剂疫苗的患者中,CIN I、II 和 III 病变的消退率分别为 75.6%、78% 和 72.1%。这些消退率可以与对照组进行比较,对照组的 CIN I 消退率为 45.7%,CIN II 消退率为 40%,CIN III 病变消退率为 41.2%。在比较接种疫苗的人和未接种疫苗的人时,所有三个等级的回归率都显著降低 (p = 0.02, 0.03, 0.03)。Jentschke 等人在 2020 年对预防性疫苗的荟萃分析报告了接种疫苗前通过锥切手术切除宫颈病变对于降低 CIN 病变风险的重要性。这项研究发现,在锥切术和随后的 HPV 疫苗接种后,CIN II 或更高的复发风险为 3.1%,而有锥切术但未接种疫苗的人的复发风险为 5.3%。
接种疫苗前需要手术切除可能是由于宫颈 TNF-α 和促炎细胞因子减少,这降低了 HPV 感染持续存在的可能性,从而使 HPV 疫苗接种的目标类似于幼稚的环境。在这些情况下,疫苗基本上是预防再次感染,而不是实际治疗它,但尽管如此,CIN 复发的风险似乎确实较低。2023 年的一项审查还讨论了预防性疫苗接种的潜在机制,指出切除后 HPV 相关疾病需要非感染细胞的新感染,这可以通过 HPV 疫苗接种来预防。该分析强调,虽然疫苗可以防止 HPV 的新感染或再次感染,但如果残留病灶仍然存在,预防性疫苗仍然不太可能阻止疾病进展。
尽管目前可用的预防性 HPV 疫苗和新开发的治疗性 HPV 疫苗在治疗和预防 HPV 相关疾病方面显示出前景,但需要进一步研究来确定每种疫苗类型的功效。临床指南反映了对额外数据的需求,因为它们尚未更改以包括有关预防和治疗性 HPV 疫苗使用的任何建议。
结论
HPV 感染是一个全球性的公共卫生问题,与从良性疣到危及生命的恶性肿瘤等疾病有关。过去半个世纪的研究为了解病毒的生物学特性及其临床影响提供了重要的见解。成功疫苗的开发减少了 HPV 相关疾病,并为用于治疗带来了希望;然而,这种疫苗仍然存在障碍,尤其是在低收入和中等收入国家。需要努力开展教育、疫苗接种运动和持续研究,以降低全球与 HPV 相关的发病率和死亡率。
via: Jensen JE, Becker GL, Jackson JB, Rysavy MB. Human Papillomavirus and Associated Cancers: A Review. Viruses. 2024 Apr 26;16(5):680. doi: 10.3390/v16050680. PMID: 38793561; PMCID: PMC11125882.

评论
发表评论
欢迎交流指正