HPV介导的恶性肿瘤-2025 更新
简介
HPV 感染是全球最常见的性传播感染,社会影响重大。男女均可感染 HPV,且女性更易感染,据估计,80% 的女性在 50 岁之前可能感染生殖器 HPV。HPV 已被世界卫生组织确认为是多种癌症的病原体。大约 5% 的人类恶性肿瘤,如宫颈癌、外阴癌、阴道癌、阴茎癌、肛门癌、头颈部癌,尤其是口咽部和口腔癌,都是由 HPV 引起的。每年有超过 40 万人死于这些癌症。其中大约 90% 以上的宫颈癌是由 HPV 感染引起的。 HPV 相关恶性肿瘤的主要诱因是病毒的持续感染及其致癌基因的活性。由于缺乏明显症状,HPV 感染通常无症状,但在生殖器官中可观察到一些可能发展为侵袭性恶性肿瘤的病变。目前已知的 HPV 基因型有很多,根据其致癌能力分为高危 HPV (HR-HPV) 和低危 HPV (LR-HPV)。国际癌症研究机构 (IARC) 现已确认 229 种 HPV 基因型,并且还在不断增加。HR-HPV 基因型是导致大多数 HPV 相关癌症的病因。例如,已知基因型 [ 16 , 18 , 26 , 31 , 33 , 35 , 39 , 45 , 51 – 53 , 56 , 58 , 59 , 66 , 68 , 72 , 81 ] 可导致人类口咽和肛门生殖器恶性肿瘤。HPV16 和 HPV18 是 70% 以上宫颈癌病例的病因,而 HPV16 则导致了全球 87% 的 OPSCC (oropharyngeal squamous cell carcinoma, 口咽鳞状细胞癌) 病例。相比之下,LR- HPV 毒株很少导致恶性肿瘤,但可能诱发生殖器、肛门、口腔和咽喉病毒疣(例如 HPV 6 和 11)。
本文探讨了 HPV 相关癌症生物学和流行病学的最新进展,重点强调了 HPV 在致癌作用中的作用。文中阐明了 HPV 诱发的致癌机制以及病毒癌蛋白对宿主细胞靶点和信号通路的影响。此外,我们还介绍了 HPV 与各种癌症的相关领域、现有的诊断和治疗方法、针对癌症癌蛋白的治疗潜力和策略、各种生物标志物以及现有的疫苗。这些潜在的靶点和生物标志物为通过早期干预、个性化治疗以及可能的治愈性药物来减轻全球 HPV 相关疾病的负担提供了途径。该领域的进一步研究对于深入了解癌蛋白介导癌症转移的分子机制,并为 HPV 诱发的转移性疾病患者制定新的诊断和治疗方法至关重要。
HPV 诱发的癌症流行病学
男性和女性均能感染 HPV。研究估计,超过 80% 的性活跃个体会在 45 岁之前感染 HPV。90% 的 HPV 感染平均在 2 年内消退。然而,尖锐湿疣和恶性肿瘤是持续感染可能导致的疾病之一。HPV-16 和 18 导致 90% 的 HPV 相关恶性肿瘤;HPV 31、33、45、52 和 58 相关肿瘤发闰率也在一直上升。HPV 感染与相关恶性肿瘤的发病率存在显著的地区差异。非洲、南美洲和欧洲部分地区的国家 HPV 感染率最高(≥ 33.87%),其次是欧洲和澳大利亚部分地区(16.93%~33.87%),北美和南美部分国家的感染率较低(16.93%~16.93%)。亚洲的 HPV 感染率总体较低,但在 2004 年至 2017 年期间呈上升趋势。世界各地的 HPV 感染率各不相同,发展中国家的患病率 (42.2%) 高于发达国家 (22.6%)。
研究表明,高达 99.99% 的宫颈癌 (CC) 感染 HPV,两者有很强的相关性。全球每年约有 57 万例宫颈癌因感染 HPV 引起,占所有女性恶性肿瘤的 8.6%。由于筛查和预防措施,宫颈癌的患病率已显着下降。然而低收入和中等收入国家,尤其是南美洲、非洲和亚洲的国家,面临着不成比例的高 HPV 相关 CC 负担。世界卫生组织 (WHO) 于 2020 年发起了全球消除宫颈癌倡议,并预计 2030 年要实现的目标。此外,宫颈 HPV 感染与肛门癌患病率增加有关。多年来已经证明,男性肛门感染 HPV 相当普遍。富裕国家与 HPV 相关的头颈部鳞状细胞癌 (HNSCCs) 的比例正在上升,尤其是口咽鳞状细胞癌 (OPSCC)。来自更发达国家的男性 HPV 阳性 OPSCC 的负担明显更高。欧洲约为 50%,但北美的频率最高,估计为 65%。 尽管有预防措施,但 HPV 相关恶性肿瘤仍然是全球发病率和死亡的主要来源,尤其是在欠发达国家。
传播
HPV 传播的最有据可查的途径是性接触,主要是通过接触传播。经口 HPV 传播主要与性活动有关,几乎没有证据表明 HPV 可通过唾液或日常接触传播。然而,非性传播途径也是可能的,包括接触污染物、自我接种、通过手间接传播,以及在直接接触受感染母亲的生殖道或通过上行感染(尤其是在胎膜早破后)从母亲传给孩子的垂直传播。此外,研究表明 HPV 可以通过血液传播。临床采取有效措施以防止 HPV 意外传播至关重要,因为即使经过标准消毒,病毒仍可在医疗设备上存活。提高认识并实施适当的消毒方案对于减少传播及其相关的健康影响至关重要。HPV 生命周期
HPV 基因组
HPV 是一种无包膜病毒,属于瘤病毒属 papovaviridae 家族。所有 HPV 都有一个约 7.9 kb 的双链环状 DNA 基因组(图 1 A)。它由以下部分组成:(1) 早期 (E) 区编码与感染、病毒复制和肿瘤发生相关的 E1、E2、E1^E4、E5、E6、E7、E8^E2 蛋白;(2) 晚期 (L) 区编码 L1、L2 蛋白 [ 47 ]。(3) 上游调控区 (URR),也称为长链非编码控制区 (LCR),负责病毒早期启动子转录和 DNA 复制,但不负责蛋白质编码功能。URR 的多样性最高,包含 p97 启动子和调节基序。此功能(URR 分析)可用于 HPV 分类 。表达的 HPV 基因的主要特征总结于表 1 。包裹基因组的二十面体壳由 360 个拷贝的单个蛋白质组成,L1 排列成 72 个五聚体帽粒,很可能在中心仅包含一个 L2 拷贝。HPV 还具有早期 (PE) 和晚期 (PL) 启动子以及聚腺苷酸化位点(pAE 和 pAL)。|
表1: HPV 基因 |
|
|
基因 |
功能 |
|
E1 |
解旋酶;参与基因组复制 |
|
E2 |
病毒生命周期的主调节因子病毒基因转录调节因子,分割病毒基因组,降低 E6 和 E7 的表达 |
|
E1^E4 |
在晚期表达为病毒晚期基因,帮助病毒通过破坏宿主细胞角蛋白网络逃逸宿主细胞 |
|
E5 |
小的疏水跨膜蛋白,具有致癌性,有助于病毒的生产生命周期 |
|
E6 |
癌蛋白;抑制 p53,通过防止细胞凋亡抵消 E7 的抗病毒作用 |
|
E7 |
癌蛋白,抑制 pRb,设置永生化和复制的细胞条件 |
|
E8^E2 |
抑制基因表达和病毒复制 |
|
L1 |
病毒衣壳的关键结构元件;在细胞分化后显示 |
|
L2 |
一种小衣壳蛋白,在整个感染过程中积极促进 HPV 病毒的组装 |
|
E,早期基因和 L,晚期基因 |
|
生命周期
HPV 的生命周期与上皮细胞中宿主角质形成细胞的分化密切相关(图 1 B)。病毒的生产期及其 DNA 随机整合到宿主染色体中的过程特异性地靶向上皮细胞的基底层 。病毒需要皮肤或粘膜的微损伤/小破口才能进入。HPV L1 衣壳蛋白附着在基底层细胞表面的细胞受体。硫酸肝素蛋白聚糖 (HSPGs) 似乎是初始结合的主要受体。HPV 入口受体包括整合素(α6 整合素)、层粘连蛋白、多配体蛋白聚糖-1、膜联蛋白-A2 异四聚体、波形蛋白和富含四跨膜蛋白的膜微结构域。HPV 基因型和细胞类型决定了受体途径。病毒通过内吞作用进入。病毒在小囊泡内穿过膜结合的胞质成分、 反式高尔基体网络和内质网 (ER) 。病毒衣壳被去除,由于囊泡中的一系列相互作用和结构改变,病毒基因组在靠近核膜的地方被释放 。当核膜破裂时,通过核孔或有丝分裂进入细胞核。在病毒进入细胞核后,进入基底层的分裂细胞,其早期启动子被激活,表达多顺反子 RNA。这种多顺反子 RNA 经过广泛的选择性 RNA 剪接以表达病毒 E6、E7、E1、E2。早期蛋白质有助于维持感染。 E1 和 E2 促进初始游离型病毒基因组复制。E6 和 E7 蛋白通过抑制细胞分化、促进细胞周期进程和防止发育中细胞凋亡来帮助维持复制。E4 蛋白是最常见的病毒调节因子,可能有助于分化角质形成细胞,从而促进病毒生命周期后期的病毒基因组扩增。晚期 DNA 复制产生了数千个病毒基因组,它需要增强的早期蛋白质来完成和释放病毒体。细胞进入上皮最外层的角质层后,新合成的病毒 DNA 与免疫原性衣壳蛋白 L1 和 L2 包裹,形成病毒体组装体,随后病毒体被释放,生命周期重新开始。新的病毒体沉积在角质层中并不断脱落。HPV 不会诱导完全细胞裂解。病毒生命周期的持续时间有一个下限,因为基底细胞分化并迁移到上皮表面大约需要 3 周。HPV 致癌性
大多数 HPV 感染是无症状的,会随着时间的推移自行消退。尽管有大量证据表明 HR-HPV 与多种恶性肿瘤有关,但 HPV 感染发展为癌症的情况很少见。基底细胞和干细胞上皮细胞的持续感染是导致癌症发展的主要因素。然而,在极少数情况下,特别是 HPV 16 型和 18 型,潜伏性 HPV 感染的再激活可能导致恶性肿瘤。持续感染期间,病毒基因组与宿主基因组的整合会改变宿主细胞的状况,从而促进恶性肿瘤的发生和进展。HPV 基因组的整合通常涉及病毒 DNA 大片段的缺失和 E2 基因的破坏(图 2)。 在这种整合形式中,E6 和 E7 基因保持完整,并且可以从位于整合位点上游的长控制区 (LCR) 转录。E2(以及负向调节 E6 和 E7 表达的 E2 阻遏蛋白)的破坏,以及整合位点附近细胞启动子元件的改变可导致 E6 和 E7 表达增加。无论感染的解剖部位如何,这种表达增加都是感染进展为恶性肿瘤所必需的关键改变。过表达的 E6 和 E7 活性干扰肿瘤抑制基因 (p53 和 Rb) 的转录、染色体不稳定、抑制分化并促进细胞增殖,共同增加恶性肿瘤的风险。此外,表观遗传修饰失调还会加速癌症的进展。 例如,HPV DNA 和宿主细胞基因组会导致肿瘤抑制基因功能障碍,从而加速恶性肿瘤。癌蛋白改变宿主细胞靶点
HPV 癌蛋白最为人熟知的作用是降解重要的抑癌蛋白,导致细胞生长失控。E7 与肿瘤抑制因子 pRb(一种视网膜母细胞瘤蛋白)相互作用,导致致癌作用,并与其他视网膜母细胞瘤口袋蛋白(如 p107 和 p130)相互作用,导致 Rb 被抑制或被蛋白酶体降解。E7 利用保守的典型 LXCXE(L,亮氨酸;C,半胱氨酸;E,谷氨酸;X,任何氨基酸)结合基序,与未磷酸化的 pRb 结合。这种结合可导致泛素化和随后的蛋白酶体破坏,释放转录因子 E2F,从而引发活性的 E2F 依赖性转录,促使细胞周期进入 S 期,促进细胞增殖,并同时促进病毒基因的转录。 E7 可以通过抑制或激活细胞周期调节蛋白(例如细胞周期蛋白 A 和 E,以及细胞周期蛋白激酶抑制剂 p21 和 p27)的表达,进一步促进细胞周期进入 G1-S 期。此外,E7 还会触发 DNA 甲基转移酶的激活,导致 DNA 甲基化程度失控。这种干扰还会干扰细胞过程的表观遗传调控 。靶向 Rb-E2 F 和其他细胞周期调节因子可产生上调 p53 的生物学效应,p53 是另一种肿瘤抑制因子,通常会通过阻止细胞生长和触发细胞凋亡来抵消这些效应。为了防止这种情况,另一种名为 E6 的癌蛋白会干扰另一种肿瘤抑制蛋白 p53 和促凋亡蛋白 BAK,抑制它们的功能,防止细胞凋亡,并允许病毒 DNA 继续复制。 E6 与泛素连接酶结合,称为 E6 相关蛋白 (E6 AP),导致蛋白酶体降解和 p53 抑制 。如图 3 所示,表达 E6 的细胞中 p53 水平显著下降,这使得它们更容易积累突变和染色体畸变,从而增加发生转化、发育不良和癌症的可能性。其他靶点涵盖多种重要成分,包括参与凋亡、调节细胞信号传导和粘附的蛋白质,以及参与分化调控和细胞周期控制的 p300/CBP 转录激活因子。此外,E6 还能触发端粒酶逆转录酶 (TERT) 的转录,这对细胞永生化至关重要。由于 DNA 受损,细胞会激活 DNA 损伤反应 (DDR)。为了促进病毒基因组复制,HPV 还会破坏宿主的 DNA 损伤反应,从而增加复制压力并增加基因组不稳定性。研究表明,在单链或双链 DNA 断裂的情况下,E7 和 E6 分别激活 ATM 和 Rad3 相关 (ATR) 以及毛细血管扩张性共济失调突变 (ATM) DNA 损伤修复途径。细胞周期停滞是由于这些 DNA 损伤修复途径的激活而发生的;然而,E7 通过导致 claspin 降解(DNA 损伤检查点修复所必需的蛋白质)来阻止这种情况的发生。头颈癌也与 DNA 损伤反应的操纵有关,因为 HPV16 E7 以 Rb 依赖的方式造成 DNA 损伤,当与其他 DNA 修复异常结合时会导致肿瘤生长。 随着宫颈鳞状上皮内病变严重程度的进展,磷酸化 CHK1、pCHK2、FANCD2 和 BRCA1 等 DNA 修复因子的表达增加,表明这些途径在恶性肿瘤进展中可能发挥作用。图 3 列出了 E6 和 E7 的宿主细胞靶标。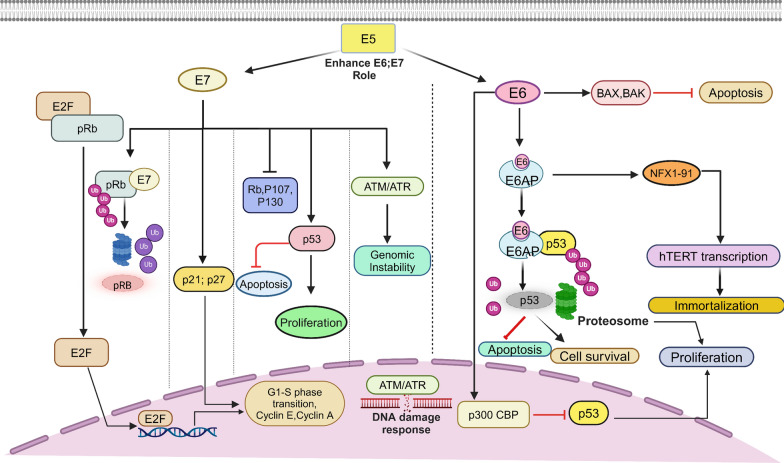
HR-HPV 的典型感染生命周期依赖于所有这些相互作用。然而,这些细胞调控网络和信号通路可能由于 E6/E7 表达升高而失调,从而导致肿瘤进展。此外,HPV E5 蛋白也可能促进癌变的发生。E5 似乎增强了 E6 和 E7 在肿瘤生长中的作用,并且它具有许多已知的可能有助于转化过程的活性。研究还表明,HPV16 E5 癌蛋白与宫颈病变相关,并可能在癌变过程中影响细胞凋亡、细胞增殖和分化。
改变细胞信号通路的癌蛋白
HPV 早期蛋白通过控制多种肿瘤相关信号通路的异常激活或失活,促进肿瘤细胞的恶性发展(图 4 )。E5 在调节细胞增殖、病毒复制以及触发肿瘤发生的多种信号通路中至关重要。E5 可以与表皮生长因子受体(EGFR)结合,启动 MAPK/ERK 和 PI3K/AKT 通路。EGFR 激活 MEK 1/2 和 PI3K,进而分别磷酸化 ERK1/2 和 AKT。血管内皮生长因子(VEGF)是血管生成的关键元素,最终会升高。AKT 激活导致 p21 和 p27 磷酸化,导致其在细胞质中积累,并失去抑制细胞周期依赖性蛋白激酶(CDK)4/6-细胞周期蛋白 D1 活性的能力,从而促进细胞从 G 期向 S 期转变。 S 期延长,导致基底层细胞增殖增加,病毒基因组复制加速。此外,MAPK 激活维持细胞周期蛋白 D1 的表达,从而促进细胞增殖并激活激活蛋白 1 (AP-1),这对于启动和维持 E6 和 E7 表达至关重要,进而扩增病毒表达 [ 107 ]。研究表明,在 HPV 阳性 CC 患者中,c-Jun(AP-1 二聚体)高表达与不良预后相关。E5 还通过下调主要组织相容性复合体 (MHC)-I 表达和抑制 MHC II 转运至细胞表面进行抗原呈递来逃避免疫反应。E6 能够诱导细胞增殖失控。E6 调控 PI3K/Akt/mTOR 通路。mTORC2 磷酸化 Akt 可激活 mTORC1,抑制自噬,促进病毒复制和细胞增殖。它还通过下调细胞周期蛋白抑制激酶(如 p21、p27 和 CDK)的表达,导致细胞增殖失控。研究表明,E6/E7 可以靶向 Notch1 来避免细胞衰老。激活的神经源性基因位点 Notch 同源蛋白 1(Notch 1)可维持 HPV16 E6 和 E7 诱导的转化,并阻止 p53 诱导的细胞凋亡。E6 通过 Ras 相关的 C3 肉毒杆菌毒素底物 1/NF-κB 通路促进 IL-6 的产生,从而增强 STAT3 信号转导。STAT3 随后可增强 E6 的表达。激活的 STAT3 可促进与细胞增殖相关的基因转录。HPV 相关的恶性肿瘤也表现出 wnt/β-catenin 通路的上调,这是另一条负责细胞分裂、迁移和增殖的信号通路。据报道,E6 可促进 Wnt 信号下游靶基因(如细胞周期蛋白 D1 和 C-myc)的产生,并有助 β-catenin 核易位,从而促进细胞生长和增殖 E6 促进 MZF1 的表达,从而导致 NKX2-1 和 FOXM1 的转录。FOXM1 增强 β-catenin 的转录和易位。在 HPV-16 和 HPV-18 阳性细胞中,E6 可增加细胞外囊泡 Wnt7b,Wnt7b 可显著增强 β-catenin 信号传导,从而增强血管生成和癌症侵袭。 干扰素调节因子 3 与 E6 相互作用,抑制其磷酸化、转录活性和易位,从而抑制下游 IFNβ 的产生,使 HPV 逃避免疫反应。
另一种致癌蛋白 E7 可引发 DNA 损伤和基因组不稳定性,从而促进癌症的发生和发展。研究发现,HR-HPV16 E7 可刺激 PI3K 信号传导。AKT 表达增加会促进 Pirin 表达,进而激活 NF-κB 信号级联,从而促进 CC 和口腔癌细胞的细胞迁移和 EMT。E7 与凝溶胶蛋白相互作用,驱动细胞骨架肌动蛋白重组并促进 pYAP 在细胞质中滞留,也可诱导 EMT。YAP1 激活超过致癌阈值会导致宫颈癌。E7 可能调节 EMT 相关转录因子 Slug 的表达,从而增加波形蛋白表达并降低 E-钙粘蛋白表达,同时促进 EMT 和细胞迁移。 HPV-16 E7 和 E6 协同增强 β-catenin 在细胞核内的积累,上调 c-Myc 和转录因子的表达,并促进 EMT 的发生。据报道,HPV16 E7 可能通过增强长链非编码 RNA lnc-FANCI-2 的表达来阻止 p70S6K、4E-BP1 和 AKT 的磷酸化。上调 c-MYC、Bax 和胰岛素受体的表达,导致细胞增殖和癌症进展。E7 还通过抑制 RIG-1 和 cGAS-STING 通路激活以及 IFN 的产生和释放来帮助免疫逃避。这些是受 HPV 癌蛋白调节以促进致癌作用的各种致癌信号通路。
HPV 与癌症
HPV 相关恶性肿瘤的主要风险因素是 HPV 感染。HPV 感染通常处于免疫系统的控制之下,会在一两年内从体内消失。长期高危 HPV 感染会导致细胞发生改变,如果不及时治疗,可能会随着时间的推移而恶化,最终发展为癌前病变和癌症。六种癌症与 HPV 有关:宫颈癌、外阴癌、阴茎癌、阴道癌、口咽癌和肛门癌。如图 5 所示,据估计,90%的宫颈癌和肛门癌、70%的外阴癌和阴道癌、60%的阴茎癌以及 70%的口咽癌是由慢性高危 HPV 感染引起的。这些器官的内表面覆盖着感染 HPV 的鳞状薄扁平细胞。大多数与 HPV 相关的癌症被称为鳞状细胞癌。某些宫颈恶性肿瘤,例如腺癌,是由 HPV 感染腺细胞引起的。
宫颈癌
80% 从事性活动的女性在其一生中的某个阶段会感染 HPV。大约 90% 的受感染女性已被证实病毒被清除。然而,10% 的受感染女性仍会继续感染病毒 ,导致 E5、E6 和 E7 介导的突变,这些突变可能引发癌症。鳞状细胞癌 (SCC) 和腺癌 (AC) 是宫颈癌的两种组织学亚型。SCC 源自宫颈外口的鳞状细胞,占 75% - 83%;而 AC 源自宫颈内产生粘液的腺细胞,占 12% - 25%。鳞状细胞癌进展过程中,HPV 感染后,宫颈上皮鳞状细胞会发生发育不良改变,这些病变被称为宫颈上皮内瘤变 (CIN) 。构成 CIN 的上皮改变可分为三类:CIN1 至 CIN3。CIN1 病变,也称为低级别 CIN,是保留了产生病毒颗粒和完成 HPV 生命周期的能力的扁平疣。在这种情况下,增殖较低,占据上皮底部三分之一。CIN2 病变占据下上皮三分之一到三分之二的基底细胞。CIN3 病变是宫颈癌的早期阶段,占据上皮厚度的三分之二。 鉴于CIN2 和 CIN3 发展为宫颈癌的倾向,被视为高级别 CIN。 只有 10% 至 20% 的持续性 HPV 感染有可能发展为宫颈癌,大多数感染在感染几年后会消失。如果已经形成持续性感染,HPV 可以整合到宿主基因组中,这在癌症的发展中起着关键作用,其中 HPV-人融合转录本是恶性转化的主要驱动因素;80% 的 HPV-16 阳性宫颈癌和 100% 的 HPV-18 阳性宫颈癌都可观察到病毒整合。目前使用的治疗方法包括手术、放射疗法和化学疗法,但创新的免疫疗法有可能改善预后并提高患者生存率。多年来,对 HPV 生物学特性的深入了解已导致人们鉴定出多种生物标志物,这有助于开发更有效的治疗方法和更好的预后。头颈部鳞状细胞癌
头颈癌每年新发病例 47,813 例,死亡 10,492 例,约占美国所有新发癌症病例的 3%。头颈部鳞状细胞癌 (HNSCC) 可发生于上呼吸消化道的各个部位,如口腔、鼻咽、鼻窦、口咽、下咽和喉。其中,男性 OPSCCa 发病率最高,且因 HPV 而呈上升趋势。据报道,所有 HPV 阳性 OPSCCa 中至少 85% 与 HPV-16 有关。据预测,未来十年病例数还会增加,到 2029 年每年将超过 3 万例。这是由于过去 50 年来口交行为增多,尤其是年轻人。研究发现,HPV 相关 HNSCC 的发病机制受肿瘤内异质性的影响,包括遗传、表观遗传和组织病理学变异。临床试验观察到的治疗反应均受这种异质性的影响。肛门生殖器癌
40%-85%的肛门癌、阴茎癌、阴道癌和外阴癌与 HPV 有关。肛门生殖器感染可以作为宫颈感染的病毒储存库,而宫颈感染又可以作为肛门生殖器感染的 HPV 病毒储存库。肛门癌
HPV 感染与 90% 的肛门癌密切相关,其中 HPV16 是最常见的类型,占 75%。肛门癌在男女发病率越来越高;在高危人群中更常见,如 HIV 阳性者和男同性恋者。常先发生癌前病变。鳞状细胞癌 (SCC) 是肛门直肠区域最常见的肿瘤组织学类型。20–30% 肛门 SCC 患者通常没有症状,因此诊断变得困难或延迟。最近研究表明,治疗肛门高级别鳞状上皮内病变 (HSIL) 可显著降低罹患肛门癌的风险。 HPV 疫苗接种可有效预防肛门 HPV 的早期感染 。高分辨率肛门镜检查 (HRA) 是筛查和诊断肛门发育不良和癌症的金标准。然而,肛门细胞学分析和肛门 HPV 检测均存在局限性,而高分辨率肛门镜检查由于其价格昂贵且普及性有限,并非一种实用的筛查方法。因此,需要开展更多研究来增强肛门 HSIL 检测的筛查算法。外阴癌和阴道癌
阴道癌和外阴癌相对罕见,但全球发病率正在上升。部分与 HPV 感染流行病学的加速有关。高收入国家这两种癌症的发病率往往更高。78% 的阴道癌与 HPV 感染有关;25% 的外阴癌与 HPV 感染有关。两者会导致外阴浸润性鳞状细胞癌 (VSCC);三分之一的外阴鳞状细胞癌与 HPV 相关。这种差异可以从其之前的病变中看出,分别称为分化型外阴上皮内瘤变 (dVIN) 和 HSIL。dVIN 比 HSIL 发展为癌症的可能性更大。另一方面,衰老和持续性炎症性疾病(如硬化性苔藓 (LS))与 HPV 阴性外阴癌及癌前病变有关。晚期外阴癌患者的治疗效果不佳,早诊断早治疗预后会更好。外阴癌的发病率远低于宫颈癌,但其发病率高于阴道癌。与宫颈复发相比,HPV 疫苗接种在预防外阴阴道复发方面的有效性证据不足。
阴茎癌
阴茎癌 (PC) 是男性泌尿生殖系统中一种罕见的恶性肿瘤,根据全球癌症统计数据 (GLOBOCAN),2020 年全球估计有 36,068 例新发病例和 13,211 例死亡。PC 主要由生殖器疣和癌前病变发展而来。阴茎上皮内瘤变 (PeIN) 发生在粘膜上皮区域,最常见于阴茎龟头和包皮,HPV DNA 感染率为 45.5%。研究还表明,阴茎癌的恶性转化有两种可能的途径,具体取决于是否存在 HPV 感染。与外阴癌一样,大多数(高达 90%)阴茎癌的癌前病变 PeIN 为 HPV 阳性,其中 HPV 16 是最常见的基因型(40%)。相大约一半(50%)的阴茎癌与 HPV 有关。其他如包茎、慢性炎症、肥胖、吸烟、UVA 光疗、免疫抑制、多名性伴以及社会经济因素也是引起阴茎癌及其癌前病变的因素。HPV 疫苗是预防 HPV 诱发癌症的主要策略。这些疫苗可以降低 HPV 感染的可能性。HPV 疫苗对高危 HPV 亚型(如 HPV 16 和 18)诱发的相关癌前病变和癌症非常有效。定期筛查和 HPV 检测对成年人以及高危患者很重要。包皮过长可能感染 HPV 等性传播疾病的风险较高,因为包皮过长男性由于生殖器粘膜更多地暴露于 HPV 而更容易患上生殖器疣。所有年龄段的 HPV 感染率似乎都较高;然而,HPV 相关的外阴癌和阴茎癌的发病率明显低于宫颈癌,这表明外阴和阴茎上皮可能更感染 HPV 产生病毒子代(或更可能受宿主免疫控制),而非更容易进展为恶性转化增殖性感染。阴道癌也符合这些原则。
诊断
期诊断 HPV 至关重要。由于 HPV 感染的复杂性,定期筛查对于监测 HPV 相关病变至关重要( 表 2 )。|
表 2,HPV 诊断方法 |
||
|
方法 |
优点 |
缺点 |
|
细胞学或巴氏涂片 |
操作简单,易学习,成本低,实验室要求 低 |
灵敏度差、特异性低、重复性不足 |
|
醋酸白试验 |
快速有效,操作简单 |
有假阳性 |
|
阴道镜 |
无创无痛、灵敏度高 |
特异性较低 |
|
液基薄层细胞检测 |
检出率更高 |
专业性要求高 |
|
HPV DNA PCR |
灵敏性和特异性高 |
不能指导预后 |
|
mRNA PCR |
灵敏性和特异性高,可反应病毒的转录,可指导预后 |
所需更多的专业知识 |
细胞学筛查
识别由 HPV 感染引起的癌前病变和癌性病变的主要方法是细胞学筛查,包括巴氏染色(巴氏涂片)、阴道镜检查或目视检查分析。细胞学检查或巴氏涂片检查
巴氏涂片检查可发现异常宫颈上皮细胞,这些细胞可能是宫颈癌或癌前病变的征兆,并可作为常规宫颈癌筛查。巴氏涂片检查已显著降低宫颈癌的发病率和死亡率。巴氏涂片检查的主要临床局限性包括敏感性有限、特异性低、可重复性不足,以及需要每年或每三年进行一次检测。醋酸白试验
醋酸白试验 ( VIA ) 是细胞学检查的良好替代品。巴氏涂片检查步骤繁琐,需有细胞病理学专业知识人员。醋酸白相对简单。使用 3-5%的醋酸溶液涂抹在宫颈上一到两分钟,观察宫颈变化,如出现白色变化,则提示有感染 HPV 可能。研究表明,早期采用 VIA 进行诊断可将宫颈癌发病率降低 25%,死亡率降低 35%。尽管 VIA 灵敏度更高,但其假阳性率也较高,因此大规模筛查时很少用到 VIA。阴道镜检查
阴道镜它是一种介于裸眼和低倍显微镜检查之间的中间诊断技术。该技术可以识别肉眼难以察觉的细微病变,精确定位病变,并可取样进行组织病理学分析,从而提高诊断准确性,尤其对于无症状的早期宫颈癌。该检查费用低廉,人员培训简单,且操作过程无创无痛,患者依从性高。然而,该技术敏感性高,但特异性低。液基薄层细胞检测(TCT)
采用液基薄层细胞检测系统检测宫颈细胞并进行细胞学分类诊断,它是一种宫颈癌细胞学检查技术,与传统的宫颈刮片巴氏涂片检查相比明显提高了标本的满意度及宫颈异常细胞检出率。同时还能发现部分癌前病变,微生物感染如霉菌、滴虫、病毒、衣原体等。HPV 检测
HPV 检测比单独的巴氏涂片检查更敏感,并且宫颈病变的假阴性率更低。目前已开发出多种 HPV 检测技术,例如第2代杂交捕获法(HC2)和多重荧光聚合酶链反应(PCR),可以识别与宫颈癌相关的高危 HPV 基因型。在许多发达国家,HPV 检测作为一种额外的宫颈癌筛查技术。由于 PCR 检测具有高灵敏度、特异性以及同时检测多种 HPV 类型的能力,因此常用于诊断生殖器疣、宫颈癌筛查和其他 HPV 相关疾病。虽然 HPV DNA 检测可用于确诊 HPV 感染,但它无法显示感染的进展情况。因此,人们创建了其他检测方法,特别是针对病毒癌蛋白或 E6/E7 mRNA 的检测方法,以确定病毒在受感染细胞中的活跃转录,并提供有关疾病预后的更精确信息。基于 PCR 的检测被视为金标准,常用于在核酸水平上识别 HPV。近年来,出现了更先进的分析工具,例如等温扩增技术 (IAT) 和基于 CRISPR-Cas 的系统,这些工具可能在易用性、经济实惠或时间效率方面具有优势。例如,在宫颈癌和口咽鳞状细胞癌中,环介导等温扩增 (LAMP) 已成为一种快速且经济地识别高危 HPV 亚型的可行方法。它与目前的金标准 PCR 灵敏度和特异性相当。此外,AmpFire HPV 检测在识别患者和临床医生采集的样本中的 CIN2 + 和 CIN3 + 时表现出与基于 PCR 的检测相似的灵敏度,使其有资格用于大规模筛查计划。同样,CRISPR-Cas 系统也已用于检测 HPV。科学家们已经创建了基于 CRISPR-Cas12a 的检测方法,该方法在识别各种临床样本(例如血浆和肛拭子)中的 HPV16 和 HPV18 DNA 方面表现出极高的灵敏度和特异性。通过将 CRISPR-Cas 技术与重组酶聚合酶扩增 (RPA) 等恒温扩增技术相结合,这些检测方法可在 35-80 分钟内得出结果,无需昂贵的设备或高水平的技术能力。
联合检测
人们正逐渐从单纯依赖细胞学检测转向采用联合检测,即将细胞学检测和分子检测结合起来,以提高筛查效果。一项研究报告称,联合检测对 CIN 3 级或更高级别 (CIN3 +) 的检出灵敏度高 (99.4%)。另一项研究发现,联合检测对检测 AIN2 + 的灵敏度可达 93%。然而,联合检测的假阳性率高于单独使用巴氏试验。这些筛查方法凸显了在高危 HPV (HR-HPV) 感染和异常细胞病变(如癌前病变)发展为恶性肿瘤之前发现它们的潜力。筛查标准
许多协会已根据年龄和 HIV 合并症情况,为处于平均风险水平的女性提供了筛查标准,包括宫颈癌和 HPV 筛查标准。这些指南基于 WHO、USPSTF(美国预防服务工作组)和 CDC 的建议(表 3 )。CDC 目前不建议男性常规筛查 HPV 感染,因为目前尚无获批的检测方法。但是,对于有肛交行为或 HIV 阳性的男性,可以进行肛门巴氏涂片检查。HPV 筛查主要针对高危人群,重点是宫颈癌和肛门癌。因此,筛查 HPV 相关口咽癌的机会有限。需要进一步研究以制定检测和筛查其他癌症(如口咽癌)HPV 感染的有效策略。|
表 3,CDC、USPSTF 和 WHO 有关HPV
筛查的建议 |
||
|
人群 |
WHO |
CDC 和USPSTF |
|
< 21 |
不建议 |
不建议 |
|
21-30 |
不建议 |
3 年一次巴氏涂片 |
|
30-65 |
5-10 年一次HPV DNA;2 次阴性检测结束 |
3 年一次巴氏涂片,5 年一次巴氏涂征和HPV DNA 联合检测,或每 5 年一次HPV DNA检测 |
|
HIV 感染 |
25 岁始,每 3-5 年一次HPV DNA 检测 |
21 岁始每年 1 次巴氏涂片或巴氏涂片联合HPV DNA 检测,持续 3 年,然后每 3 年 1 次持续终身 |
|
USPSTF : United
States Preventive Services Task Force,美国预防临床服务指南工作组 |
||
为了支持宫颈癌消除战略,需要扩大和加强基于监测的有效宫颈筛查项目。利用基于调查的方法,开展基于人群的筛查研究,鼓励女性参与筛查项目,实施细胞学或免疫印迹法(VIA)的常规筛查,以及改善资源匮乏地区的基础设施和医务人员条件。此外,世界卫生组织强调,HPV DNA 筛查允许自我采样,有助于提高筛查率,因为一些女性可能更喜欢自我采样,而不是传统的由医疗服务提供者进行检测的方法。
生物标志物
生物标志物在检测和预测与 HPV 相关的恶性肿瘤方面发挥着重要作用。这些标志物可以改善临床治疗方案,并可能通过促进 HPV 感染及其进展的早期诊断来挽救生命,尤其是在发展中国家。表 4 列出了几种有望用于诊断和管理 HPV 感染的生物标志物。|
表 4,宫颈癌和
HR-HPV 感染筛查和诊断的生物标志物 |
||||
|
生物分子 |
肿瘤类型 |
生物标志物 |
表达 |
结果 |
|
mRNA |
CC |
E6/E7 |
高 |
皮损加重 |
|
CAPZB |
高 |
区分宫颈 LSIL- 和 HSIL+ |
||
|
HNSCC |
TP53 |
低 |
提高生存率有关 |
|
|
NRF2 |
低 |
|
||
|
KEAP |
高 |
|
||
|
NQO1 |
低 |
|
||
|
ZNF540 |
高 |
提高总生存率 |
||
|
FDCSP |
高 |
提高总生存率 |
||
|
miRNA |
CC |
miR-21 |
高 |
疾病进展 |
|
miR-29a |
低 |
|
||
|
miR-15a-5p |
高 |
HPV 阳性宫颈癌患者表达更高 |
||
|
miR-17-5p |
|
|
||
|
miR-21-5p |
|
|
||
|
miR-218 |
低 |
下调参与宫颈癌发病机制 |
||
|
miR-375 |
低 |
宫颈癌进展 |
||
|
OPSCC |
miR-182-5p |
高 |
预后指标 |
|
|
miR-133a-3p |
|
|
||
|
miR-205-5p |
|
|
||
|
TSCC/BOTSCC |
miR-155 |
高 |
提高总生存率和无进展生存期 |
|
|
lncRNA |
CC |
RUSC1-AS1 |
高 |
预后指标 |
|
LINC01411 |
|
|
||
|
LINC01990 |
|
|
||
|
LINC02099 |
|
|
||
|
LINC00452 |
|
|
||
|
ADPGK-AS1 |
|
|
||
|
C1QTNF1-AS1 |
|
|
||
|
H19 |
|
|
||
|
LINC01101 和LINC00277 |
低 |
随病变和癌症进展而降低 |
||
|
HNSCC |
PRINS |
高 |
提高总生存率和无进展生存期 |
|
|
蛋白质标志物 |
CC |
P16INK4a |
高 |
预后指标 |
|
MCM2 |
高 |
预后指标 |
||
|
CA-125 |
高 |
用于宫颈癌和卵巢癌的诊断 |
||
|
SCCAg |
高 |
治疗反应不佳和生存率较低 |
||
|
OPSCC |
P16INK4a |
高 |
预后指标 |
|
|
肛门癌 |
TOP2 A |
高 |
预后指标 |
|
|
DNA 甲基化 |
CC |
DAPK1, RARB, TWIST1, EPB41L3, LMX1, HPV16 L1 |
DNA 甲基化模式的表观遗传修饰 |
预后生物标志物和潜在诊断指标 |
|
遗传标志 |
CC |
P53、PTEN、PIK3 CA、Kras 突变 |
基因改变 |
与治疗耐药、预后不良、预测治疗反应和总生存期相关 |
|
CC,宫颈癌;HNSCC,头颈部鳞状细胞癌;OPSCC,口咽鳞状细胞癌;TSCC/BOTSCC,扁桃体和舌根癌; |
||||
mRNA 生物标志物
多年来,人们已充分证实 mRNA 可以作为基因转录活性的精确指标。HPV E6/E7 mRNA 检测可作为宫颈癌筛查的潜在生物标志物。多项研究已评估了检测宫颈刮片中的 mRNA 转录本以识别宫颈癌前病变的效果。研究表明,为了在 HPV 检测呈阳性的女性中识别 HSIL,宫颈脱落细胞中的 E6/E7 mRNA 检测方法与细胞学分诊类似。另一项研究报告称,在与病变进展相关的高级别病变中,E6/E7 mRNA 的阳性率为 100%。这些发现表明,检测 E6/E7 mRNA 可以作为宫颈癌的宝贵生物标志物和筛查工具,有可能减少不必要的检查并减轻患者的担忧。此外,最近的研究发现,CAPZB mRNA 水平可作为 HR-HPV 感染的补充标志物。HPV 阳性 HNSCC 患者, KEAP1 基因高表达以及 NRF2 、 TP53 和 NQO1 基因低表达预示更高的生存率。ZNF540 mRNA 表达较高的 HPV 阳性 HNSCC 患者总体生存率 (OS) 较高。另一项研究表明,趋化因子相关的预后生物标志物滤泡树突状细胞分泌蛋白 (FDCSP) 表达增加与 HPV 阳性 HNSCC 患者预后改善相关。
ncRNA 生物标志物
非编码 RNA(ncRNA)在 HPV 驱动的恶性肿瘤中发挥着重要作用。长链非编码 RNA(lncRNA)和微小 RNA(miRNA)属于在 HPV 相关恶性肿瘤中失调的非编码 RNA(ncRNA),与肿瘤预后和进展相关。这些 RNA 在追踪妇科恶性肿瘤的不同细胞功能方面发挥着重要作用,目前已有多项临床试验正在进行中,旨在寻找 ncRNA 的生物标志物和潜在的治疗益处。miRNAs
miRNA 可作为宫颈癌诊断和 HPV 感染的生物标志物。miRNA 失调可能是宫颈癌发展的一个重要因素,因此特定 miRNA 可能为癌症筛查和预后评估的标志物。据报道,在浸润性宫颈癌的进展中,miR-16、miR-21、miR-25、miR-92a、miR-378 的上表达,以及 miR-22、miR-27a、miR-29a 和 miR-100 的下表达是最常见的 miRNA 表现形式。其他研究结果显示宫颈癌组织中几种 miRNA 水平上调,包括 miR-15a-5p、miR-17-5p 和 miR-21-5p。据报道,与 68 个正常组织相比,170 个宫颈癌组织中的 miR-375 表达大幅下降。此外,当使用六种升高的 miRNA 标志物(miR-20a、miR-92a、miR-141、miR-183*、miR-210 和 miR-944)组合时,可提高宫颈癌诊断的准确性。在 HPV 阳性的 OPSCC 中,已证实 miR-182-5p、miR-133a-3p 和 miR-205-5p 过表达,因此可用作预后指标。据报道,HPV 阳性扁桃体癌和舌根癌 (TSCC/BOTSCC) 患者的总生存期和无进展生存期 (PFS) 增加,这与 miR-155 表达增加显着相关。lncRNAs
lncRNA 也可作为 HPV 诱发恶性肿瘤的潜在生物标志物和调节剂。的研究确定了 8 个 lncRNA 组(RUSC1-AS1、LINC01411、LINC01990、LINC02099、LINC00452、H19、ADPGK-AS1 和 C1QTNF1-AS1)作为预后指标。LINC01101 和 LINC00277 的表达水平也与 HPV 存在显着相关。在宫颈病变和宫颈癌中观察到它们的表达降低。据报道,lncRNA lnc-FANCI-2 的表达是改善宫颈癌患者生存的潜在生物标志物。在 HPV 阳性 HNSCC 中,lncRNA MEG3 和 H19 似乎下调,而 PRINS CDKN2B-AS1 、 TTTY15 和 TTTY14 则被发现上调。由于免疫细胞的强浸润,HPV 阳性 HNSCC 中 PRINS 高表达的患者总体生存率和无病生存率显著较高。蛋白质标记物
多种蛋白质标志物已可作为 HPV 相关癌症生物标志物的潜力。P16INK4a 是一种肿瘤抑制蛋白标志物,常用于识别高级别宫颈病变和区分良恶性宫颈组织。它也用于评估头颈部鳞状细胞癌 (HNSCC) 中的 HPV 状态;其表达可改善头颈部鳞状细胞癌 (OPSCC) 的生存率。其他几种蛋白质生物标志物正在用于宫颈癌检测的研究,包括 survivin、Ki-67、基质金属蛋白酶 (MMP) 和组织金属蛋白酶抑制剂 (TIMP)。联合使用 p16 和 Ki-67 染色可提高诊断的准确性,尤其是在区分高级别和低级别病变。其他包括微染色体维持蛋白 2 (MCM2) 和拓扑异构酶 II α (TOP2 A),它们的表达分别与 HPV 诱发的宫颈病变和肛门癌相关。这两种蛋白质都有可能作为识别癌前病变和癌性病变的生物标志物。值得注意的是,MCM2 在 HSIL 中表现出强表达,且在 CIN 和 SCC 中的 MCM2 表达远高于正常宫颈组织 。癌抗原 (CA-125) 是另一种在宫颈腺癌 (ADC) 中升高的蛋白质生物标志物。SCCAg 是一种 SCC 肿瘤标志物,其水平升高提示 CC 患者的治疗反应不佳,生存机会减少。因此,蛋白质生物标志物在改善宫颈癌的早期发现、诊断和治疗方面具有巨大潜力。DNA 甲基化
人类和 HPV 基因的 DNA 甲基化是宫颈癌筛查和预后的潜在生物标志物。研究宿主和病毒 DNA 甲基化的变化及其与宫颈癌发展的关系,可以为该疾病的机制提供宝贵的见解,从而有助于治疗和预防工作。研究表明,宫颈病变的严重程度与宿主和病毒基因甲基化频率和水平的增加密切相关。甲基化生物标志物可以识别早期修饰,以区分高级别病变和癌症,并提高宫颈癌筛查的有效性。某些基因已显示出区分癌前病变、侵袭性恶性肿瘤和正常组织的潜力,包括 DAPK1、RARB、TWIST1、EPB41L3、LMX1 和 HPV16 L1。通过使用高度敏感且特异的高甲基化 DNA 标记物 FMN2 、 EDNRB 、 ZNF671 、 TBXT 和 MOS,可以对患有 HSIL +宫颈疾病的女性(无论 HPV 阳性还是阴性)进行准确及时的分类。在临床部署之前,特定的生物标记物需要进行额外的评估和自动化处理。遗传标记
宫颈癌的基因修饰包括多种 DNA 序列异常,这些异常可作为检测、诊断、预后和治疗反应的指标。例如,在宫颈癌侵袭期最常见的 p53 抑癌基因突变可能具有预后意义。另一个抑癌基因 PTEN 的突变通过激活 PI3K/Akt 通路促进肿瘤发生。因此,评估 PTEN 的突变可以提供预后信息并指导宫颈癌的治疗决策。与宫颈癌相关的其他基因变异包括 PIK3CA 和 Kras 突变,这些突变可能对靶向治疗产生影响。这些基因变异是宫颈癌检测、风险评估和治疗选择的重要生物标志物。然而,仍需要进一步研究来验证这些生物标志物的治疗用途,并建立标准化的检测方案,以将其整合到标准临床实践中。治疗方法
针对 HPV 早期蛋白
HR-HPV 早期 (E) 蛋白在 HPV 介导的癌症的启动中起着重要作用。通过开发针对 E 蛋白的新型治疗方法,有可能显著清除所有癌细胞。E6 和 E7 蛋白被认为是宫颈癌和头颈癌的主要致癌基因。靶向 E6 癌蛋白
E6 通过与 E6 AP 形成复合物而导致肿瘤抑制蛋白 p53 被破坏。通过抑制该复合物形成的有效治疗策略,可能重新激活 p53 的作用。化合物 Cpd12 通过干扰 E6/p53 相互作用,阻断 E6 介导的 p53 降解,已显示出令人鼓舞的效果。该方法对宫颈癌和头颈癌细胞具有广泛的活性,并且对多种高危 HPV 毒株(例如 HPV16、HPV18、HPV45 和 HPV68)有效。此外,尽管已尝试靶向 p53 或其负调节因子,但美国食品药品监督管理局 (FDA) 或欧洲药品管理局 (EMA) 尚未批准任何 p53 药物研发项目。为了开发 E6 靶向疗法,人们进行了许多尝试,例如使用 siRNA、化学物质(包括亲和体、纳米抗体、胞内抗体)和小分子抑制剂。此外,针对多种 HPV 的治疗干预可行方法是靶向 E6 与细胞蛋白的相互作用,这些蛋白包括 PDZ 结合基序或富含酸性亮氨酸的 LxxLL 基序。多羟基类黄酮、LxxLL 衍生的小蛋白和基于 LxxLL 的肽均已被用于靶向 HPV16 E6 LxxLL 结合槽。靶向 E7 癌蛋白
E7 导致肿瘤抑制因子 pRb 失活,这还会导致细胞内游离 E2F 转录因子家族 (E2F) 增多。这些事件会增加细胞周期依赖性蛋白激酶抑制剂 p16 (p16INK4a) 的表达,并导致异常增殖,这表现为 Ki-67 表达升高。这种对 p16INK4a 的依赖性依赖于其抑制 CDK4/CDK6 活性的能力,并由组蛋白去甲基化酶 KDM6B 介导。HPV 相关恶性肿瘤的一个潜在治疗靶点是 p16INK4a 依赖性。在 p16 依赖性细胞系中,KDM6B 的小分子抑制剂,包括组蛋白去甲基化酶 JMJD3/UTX 的选择性抑制剂 GSK-J4,已被证明可有效导致细胞死亡。未来的治疗可能受益于 E7 与 HDAC 抑制剂相互作用的结果,HDAC 抑制剂是一个很有前景的抗病毒靶点。由于 HDAC 的过度表达在癌症发展中起着重要作用,近期临床试验正在研究多种 HDAC 抑制剂,以抑制 E7 的活性。此外,I/IIa 期临床试验已测试了一种针对晚期 HPV 相关恶性肿瘤患者的 p16INK4a 肽疫苗接种方法,这表明存在针对 p16INK4a 进行免疫治疗的可能性。此外,E2 蛋白已被研究作为一种潜在的治疗药物;VP22-E2 融合蛋白已被证明能够穿透细胞并诱导细胞凋亡。这些癌蛋白代表了 HPV 相关癌症有希望的治疗靶点。利用基因组编辑技术进行治疗
近期研究展示了多种利用基因组编辑技术抑制 HR-HPV 相关宫颈癌中 E6/E7 表达的方法。体外和体内研究表明,局部注射 CRISPR/Cas9,同时靶向 E6 和 E7,可有效导致细胞死亡并抑制肿瘤生长。沉默这些基因可导致 HPV18 和 HPV16 癌细胞死亡,并诱导 p53 和 pRb 表达。此外,还可以通过另一种方法,即基因敲除链式反应(GKCR),靶向 HPV18 E6/E7,实现 p53/Rb 蛋白过表达和 HeLa 细胞生长抑制。因此,该技术有望用于治疗 HPV 感染及其相关的宫颈癌。转录激活因子样效应核酸酶 (TALEN) 和锌指核酸酶 (ZFN) 是另外两种基因组编辑技术,也已被研究用于宫颈癌治疗。其他疗法
根据疾病的临床分期,宫颈癌的治疗方案包括手术、化疗和放疗。历史上,以顺铂为基础的化疗一直是标准治疗方案。然而,由于单药耐药性的增加,以顺铂为基础的化疗已被证明与其他疗法(例如贝伐单抗、拓扑替康、紫杉醇、5-氟尿嘧啶或博来霉素)联合使用时更有效。此外,中国新药红色诺卡氏菌细胞壁骨架可以缓解 T 细胞耗竭,增强 HPV 感染或确诊为宫颈上皮内瘤变(CIN)患者的局部免疫反应。此外,免疫疗法,例如免疫检查点抑制剂 (ICI),例如曲美木单抗、帕博利珠单抗、纳武单抗和度伐利尤单抗,单独使用或联合使用,最近作为晚期或复发性宫颈癌的治疗选择而受到关注。对于 HPV 阳性口咽癌,免疫检查点抑制剂 (ICI) 联合放射疗法也报告了令人鼓舞的结果。针对 HPV 蛋白免疫反应的治疗方法正备受关注。例如,肿瘤浸润淋巴细胞疗法 (TIL 疗法) 提供的抗肿瘤免疫力有望对宫颈癌有效。此外,利用靶向 E7 的 T 细胞受体 (TCR) 工程化 T 细胞进行工程化 T 细胞疗法,在治疗难治性 HPV 相关癌症(包括宫颈癌、外阴癌、肛门癌和口咽癌)方面非常有效。在临床前研究中,E7 特异性 TCR 工程化 T 细胞表现出较高的功能亲和力,并在体外和小鼠模型中有效杀死 HPV-16 阳性癌细胞 。 针对 HPV-16 E6 的类似方法也在临床前研究中显示出潜力。这些发现支持了 TCR 工程化 T 细胞在治疗 HPV 相关上皮癌方面的治疗潜力。此外,咪喹莫特、鬼臼毒素和西多福韦等外用药物,以及手动去除或销毁,都是治疗生殖器疣的有效方法。疫苗接种
目前已研发并推广了多种疫苗来预防 HPV 相关癌症。疫苗接种通常与其他疗法相结合,包括放疗、化疗和免疫疗法。预防性疫苗的广泛应用显著(54–83%)降低了 HPV 相关恶性肿瘤的患病率。二价、四价和九价是三种主要的疫苗。最新的疫苗是 Gardasil ® 9,是一种九价疫苗,针对 HPV 6、11、16、18、31、33、45、52 和 58。二价疫苗针对 HPV 16 和 18,而四价疫苗针对 HPV 6、11、16 和 18。治疗性疫苗旨在通过激活对抗原 T 细胞活性有特异性的树突状细胞 (DC) 来消除亚临床 HPV 相关疾病。美国疾病控制与预防中心 (CDC) 表示,HPV 疫苗可提供至少 12 年的持续免疫力。这是由于刺激了记忆 B 细胞,而记忆 B 细胞对于保存免疫记忆至关重要。世界卫生组织 (WHO) 建议 9 至 14 岁的女孩遵循一剂或两剂的接种方案。对于 15 至 20 岁的女孩和妇女,则采用单剂或双剂计划。对于 21 岁以上的女性,则间隔 6 个月接种两剂。就疫苗接种而言,9 至 14 岁(即开始性行为之前)的女性是主要目标人群。在条件可能且经济条件允许的情况下,建议为次要目标人群(例如年龄更大的女孩和男孩)接种疫苗。通过使用九价 HPV 疫苗,可以预防 3%的喉癌、4%的口腔癌、21%的口咽癌、23%的外阴癌、25%的阴茎癌、61%的阴道癌、79%的肛门癌和 90%的宫颈癌。 尽管取得了这些进展,但由于获取途径和知识储备有限,全球疫苗接种率仍然很低,这凸显了采取更好的预防措施和教育举措的必要性。结论
综上所述,HPV 与多种恶性肿瘤(包括宫颈癌、头颈癌和生殖器癌)密切相关,凸显了其作为全球重大健康问题的重要性。尽管目前已有针对最常见致癌毒株的疫苗,但 HPV 相关癌症的发病率仍在持续上升,这凸显了持续研究的必要性。深入了解 HPV 诱发癌变的复杂分子机制,尤其是病毒癌蛋白在破坏宿主细胞功能中的作用,对于开发更有效的诊断和治疗策略至关重要。此外,发现新的生物标志物和靶向治疗方案,对于改善 HPV 相关癌症的预后也大有裨益。持续研究病毒的生物学特性及其与宿主细胞的相互作用,对于降低全球 HPV 感染造成的高发病率和死亡率仍然至关重要。via: Baba SK, Alblooshi SSE, Yaqoob R, Behl S, Al Saleem M, Rakha EA, Malik F, Singh M, Macha MA, Akhtar MK, Houry WA, Bhat AA, Al Menhali A, Zheng ZM, Mirza S. Human papilloma virus (HPV) mediated cancers: an insightful update. J Transl Med. 2025 Apr 29;23(1):483. doi: 10.1186/s12967-025-06470-x. PMID: 40301924; PMCID: PMC12039116.



评论
发表评论
欢迎交流指正